Warburg効果に関する研究
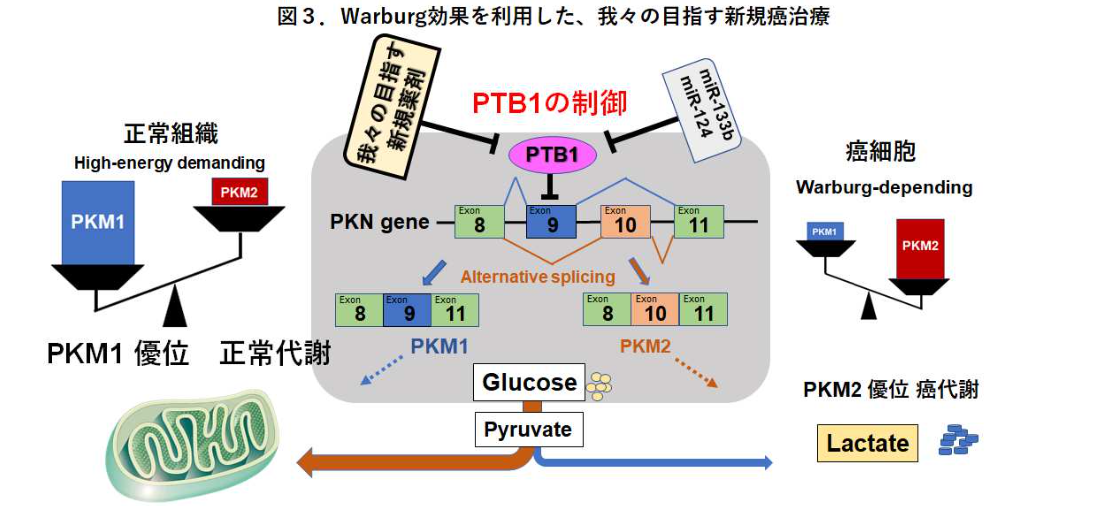
Warburg効果とは、「癌細胞はエネルギー産生において、TCAサイクルより解糖系に強く依存しブドウ糖を大量消費する」という代謝現象をいう。我々は、Polypyrimidine tract-binding protein 1(PTB1)によるPyruvate kinase muscle1/2 (PKM1およびPKM2)の遺伝子発現制御がWarburg効果に深く関与することを発見した。PTB1の発現抑制は、PKM2優位からPKM1優位へのエネルギー供給にシフトし、その結果、活性酸素産生とオートファジーが惹起され、癌細胞は増殖抑制を来たす(2015 Sci Rep; Taniguchi et al, 2016 Cancer Sci; Sugiyama et al)。マイクロRNA(miR124, miR133b)はPTB1制御の主役であるが、生体内では不安定でありDrug deliveryの面で実用性に乏しい。そこで安定性、組織移行性、特異性の面から低分子による創薬に注目した。
我々は、理論的創薬に基づいてPTB1の機能阻害をもたらす低分子化合物を創成することを目指しています。
- Sugiyama T et al. MiR-133b inhibits growth of human gastric cancer cells by silencing pyruvate kinase muscle-splicer polypyrimidine tract-binding protein 1. Cancer Sci. 2016 Dec;107(12):1767-1775. doi: 10.1111/cas.13091.
- Taniguchi K et al. Organ-specific PTB1-associated microRNAs determine expression of pyruvate kinase isoforms. Sci Rep. 2015 Feb 27;5:8647. doi: 10.1038/srep08647.
腸内細菌に関する研究
腸内細菌叢は、栄養の獲得、腸管特異的免疫系の発達、感染性病原体からの防御など、宿主の多くの生理的プロセスに寄与している。現在、多発ポリープ(腺腫)や大腸癌患者を対象に、便によるメタゲノム解析やメタボローム解析が行われ、大腸癌に関連する腸内細菌叢が同定されている。また最近の研究では腸内細菌叢の調整を通じて免疫チェックポイント阻害薬の効果が増強する可能性が示唆されている。
我々は、大腸癌患者を対象に、腸内細菌の組成を解析し、手術や抗がん剤治療による影響を解明し、治療へ繋げていくことを目指しています。
グリコカリックスに関する研究
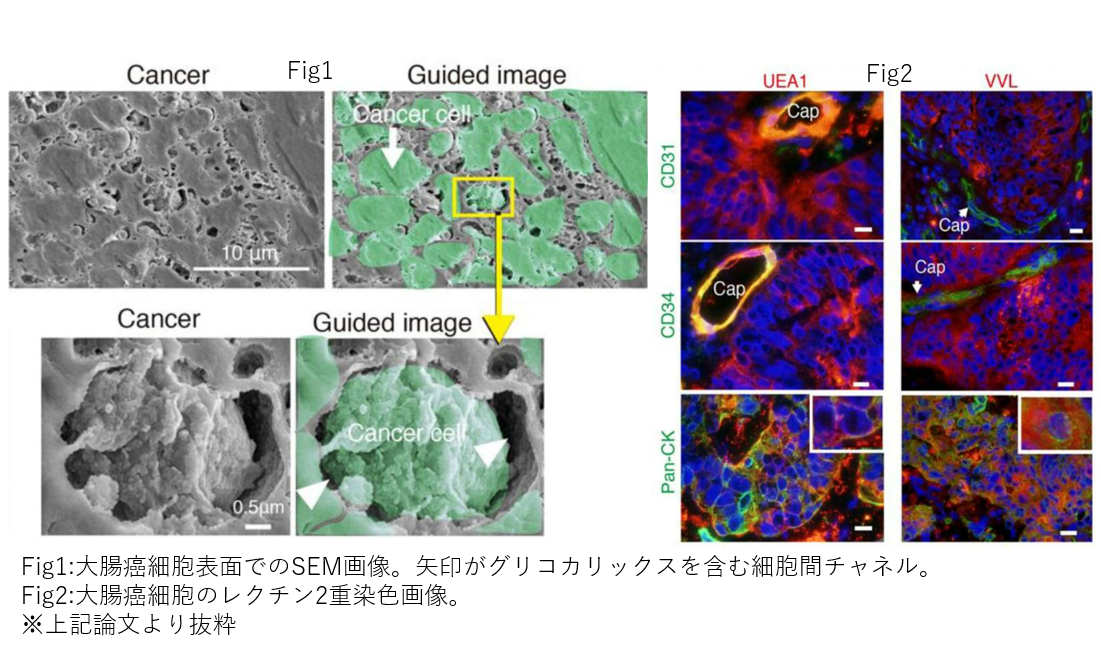
哺乳類の細胞は、糖鎖と呼ばれる糖が複雑に結合した構造体を基本としたグリコカリックスという糖タンパクが表面を覆っていることがわかっています。癌においては、その豊富なグリコカリックスが免疫細胞からの防御、浸潤における形態変化を促すシグナルトランスダクション、また血管様構造を作り、栄養を得るなど多彩な役割が報告されつつあります。しかし、そのグリコカリックスの形態やその構成成分は未だ明らかになってはいません。そこで、我々はまずはヒト大腸癌細胞を対象に、新鮮な手術採取検体を採取し、その表面構造を走査型電子顕微鏡(scanning electron microscope, SEM)で3次元撮影を行いました。また、その成分を糖鎖構造特異的に結合するレクチンを用い、染色することで検索しました。SEMでは、世界で初めて大腸癌細胞におけるグリコカリックスの立体的超微細構造の観察に成功しました。またレクチン染色により正常細胞と癌細胞のグリコカリックスの形態の違いの検討も行っております。今後も違う腫瘍での検討や肝転移などの遠隔転移病変での検討を重ねていくことで癌の転移のメカニズムの解明や、最終的には新たな薬物治療のターゲットの発見、治療法の開発を目標に日々研究を重ねております。
- Tachi M et al. Human Colorectal Cancer Infrastructure Constructed by the Glycocalyx. J Clin Med. 2019 Aug 22;8(9):1270. doi: 10.3390/jcm8091270.
1分子イメージングによる定量解析から見たoncogenic KRAS 活性化と制御機構の解明
大腸癌の治療戦略においてKRASは重要な分子ですが、恒常的に活性化する遺伝子変異を40%に認め、分子標的薬の治療抵抗性に大きく関与しています。Oncogenic KRASを阻害する新規分子標的薬の開発が進んでいますが、未だ有効な治療法開発には至っていません。そこで当教室はoncogenic KRASの活性化メカニズムと制御機構を解明し、分子標的薬によるシグナル伝達抑制効果を検証することで、大腸癌の新規治療戦略開発と画期的な評価方法の確立を目指しています。
当教室は2022年4月より東海国立大学機構 糖鎖生命コア研究所(iGCORE)の岐阜大学細胞生物物理学研究室と共同研究を行っています。細胞生物物理学研究室は1分子イメージング、超解像動画観察法を用いて、生きている細胞の形質膜上の分子を1分子ずつ観察し、シグナル伝達機構や細胞膜構造の研究を行っています。KRASはGEF、GAPを介した活性化調節機構により、EGFRからの細胞増殖シグナルを核へ伝達するスイッチとして働きます。不活性型KRASは形質膜内層を側方拡散しますが、EGF刺激で活性化すると時折、短期間一時停留します(Murakoshi et al., PNAS, 2004)。生化学アッセイでは、KRAS活性は約5分かけて増加し、再び減少する様子が観察されますが、私たちは1分子イメージング法による解析から、この一時停留中にKRASがGEFやGAP、BRAFなどと足場タンパク質を介した短寿命の複合体を形成して相互作用し、その0.2-0.5秒という短期パルス状KRASシグナルが、パルスの頻度を増減させて細胞全体のシグナル強度を調整すると考えています(図)。またEGFRとKRASは常に形質膜に局在する一方で、GEFやGAP、BRAFはシグナル伝達の過程で細胞質中から形質膜内層にリクルートされるため、時空間的な影響を強く受けること、また細胞内シグナル伝達の複雑性を考慮すると、生細胞内で分子を直接観察し、起きている事象の時間や頻度などの統計をとることが最も適した方法であり、シグナル伝達分子ごとの動態や分子間相互作用をリアルタイムに精査・定量することができると考えています。


